UKCA-Zeitplan
Mit dem Austritt des Vereinigten Königreichs aus der Europäischen Union trat die UKCA-Kennzeichnung in Großbritannien im Januar 2021 in Kraft.
Ab diesem Zeitpunkt bis Juni 2025 können Medizinprodukte und IVDs entweder mit CE oder UKCA gekennzeichnet werden. Ab Juli 2025 gelten gesetzliche Übergangsregelungen für CE- und UKCA-gekennzeichnete Medizinprodukte und IVDs, die in Großbritannien auf den Markt gebracht werden.
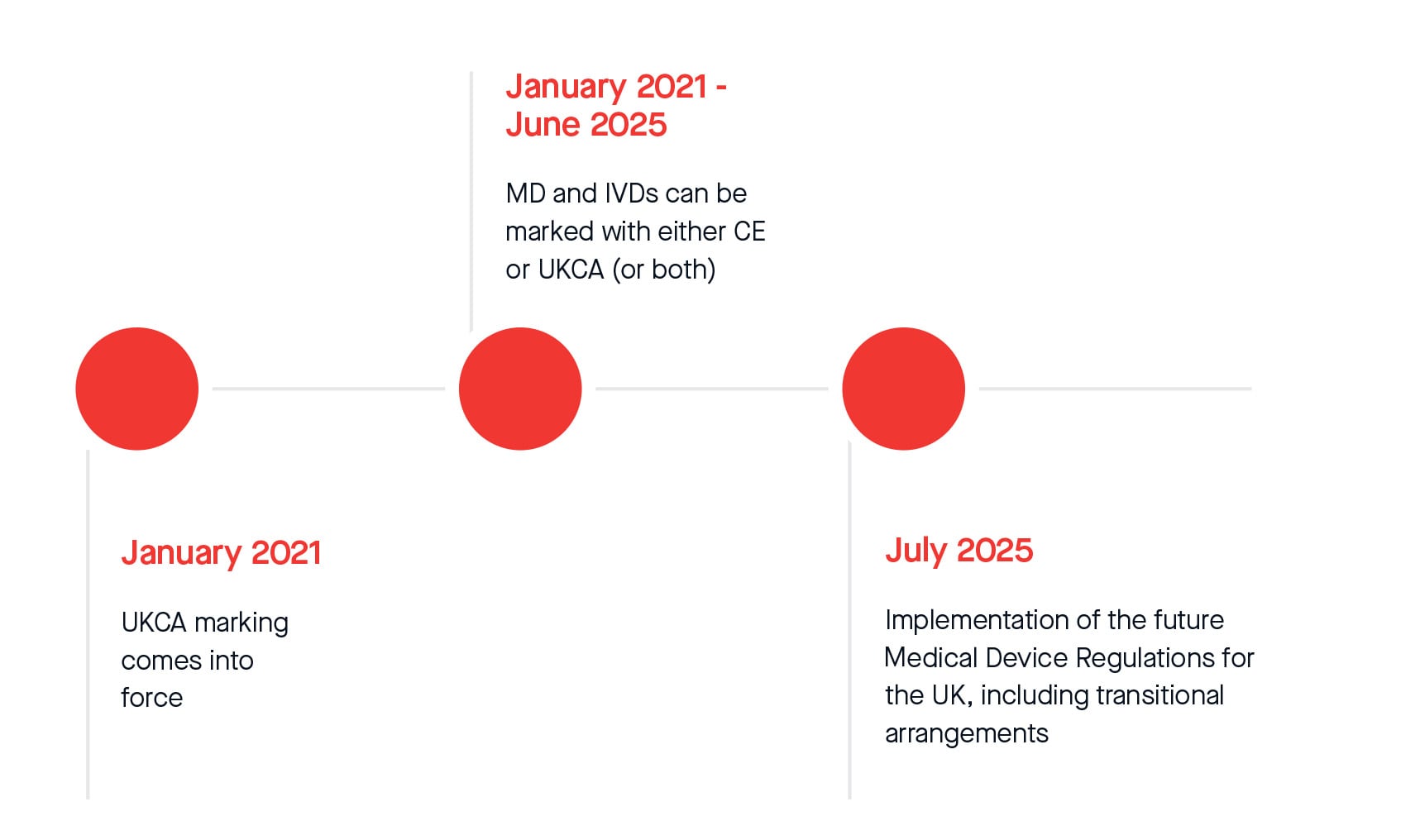
*Please note this represents current timelines that might be subject to change after New UK Regulation enters in force.
Für Nordirland gilt, dass auch nach dem 1. Juli 2025 eine CE- oder UKNI-Kennzeichnung für Medizinprodukte, die auf dem nordirischen Markt vertrieben werden, erforderlich ist, und die Hersteller die EU-Verordnungen einhalten müssen.
Auf Grundlage der Anerkennung der Verordnung (EU) 2023/607 durch die MHRA können MDD/AIMDD-zertifizierte Medizinprodukte wie folgt auf dem britischen Markt in Verkehr gebracht werden (vorausgesetzt, die in der Verordnung (EU) 2023/607 festgelegten Anforderungen werden erfüllt):
- Implantierbare Nicht-WET-Produkte der Klassen III und IIb bis Dezember 2027
- Produkte der Klasse IIb WET, Klasse IIa, Klasse Im und Klasse Is bis Juni 2028
Weitere Informationen finden Sie auf der Website der britischen Regierung.





 UKCA-Standard
UKCA-Standard UKCA-Dedicated
UKCA-Dedicated
